アレニウスの定義に対して、化学反応の中での役割に注目した定義がこのブレンステッド・ローリーの定義です。
アレニウスの定義では物質や水溶液の分類という観点から酸と塩基を定義していました。もう一度アレニウスの定義を書いてみます。
アレニウスの定義
酸(acid):水に溶けて電解し水素イオンH+を出すもの。
塩基(base):水に溶けて電解し水酸化物イオンOH-を出すもの。
酸(acid):水に溶けて電解し水素イオンH+を出すもの。
塩基(base):水に溶けて電解し水酸化物イオンOH-を出すもの。
ですが研究が進むにつれて、水素イオンH+とは陽子そのものだということが発見されました。水素から電子を一個取ったら丸裸の陽子になりますよね。そんなものが水の中で安定的に存在できるはずがない!という結論に至ります。
他にもいろいろと不都合な点が出てくるんですね。ざっと並べると次のようになります。
- 1.水素イオンが水溶液中でどのように存在しているか
- 2.「水にとける」という条件
- 3.OH-を持たないアンモニアなどの扱い
- 4.非水溶液の中和反応
これは先ほど説明しましたね。
アレニウスの定義では「水に溶けて」という条件がありますが、水酸化アルミニウムAl(OH)3、水酸化鉄(Ⅲ)Fe(OH)3なんかはほとんど水に溶けません。けど"酸性を打ち消す"という立派な塩基の性質を持っています。
中学の時にアンモニアNH3の噴水とかやったかもしれませんが、アンモニア水にフェノールフタレインを加えると赤くなりますよね。つまり塩基性です。また炭酸ナトリウムNa2CO3も塩基性を示します。
しかし、OHは持っていないんです。OHを持っていないのにどうして塩基性を示すのか?このことが説明できませんでした。
もうひとつ、水に溶かさなくても中和反応するやつもあるんです。有名なのはアンモニアNH3と塩化水素HClの反応です。どちらも気体なんですが、気体同士で反応して白煙が出るんです。これは水とは全く関係ありませんよね。
発生した白煙の正体は塩化アンモニウムNH4Clといいます。この反応ではちゃんと酸と塩基の性質を打ち消しあっています。
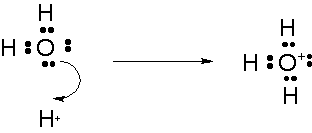
水の中に陽子がポツンとあったらどうなるのか?
陽子はもちろんプラスの電荷を帯びているわけです。しかも普通の陽イオンと違って半径がかなり小さいです。普通のイオンは半径が10-8cm程度ですが、陽子の半径は10-13cmくらいで、約10000倍の差があります。また普通のイオンは陽子の周りに電子がありますが、水素イオンは陽子が丸裸の状態で存在します。
つまりその分だけ水素イオンの電荷密度は非常に強大です。
また次の図のように、水分子は非共有電子対を持っていて極性があります。
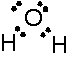
またアンモニアNH3と塩化水素HClの反応についても、HClはH+を放出してCl-になる一方で、NH3はH+を受け取ってNH4+となっています。
このように酸と塩基の反応では、水素イオンの授受が起きているということが分かると思います。このH+のやり取りに着目したのがデンマークのブレンステッドとイギリスのローリーで、彼らは1923年にそれぞれ独立に拡張した酸塩基の定義を提案しました。
ブレンステッド・ローリーの定義
酸(acid):水素イオンH+を与える物質
塩基(base):水素イオンH+を受け取る物質
酸(acid):水素イオンH+を与える物質
塩基(base):水素イオンH+を受け取る物質
この定義によると、酸の定義はあまり変わりませんが、塩基の定義は「H+を受け取るもの」として定義されています。
これは酸塩基反応における役割を表しています。
たとえば塩酸が電離する時は次のように書かれます。
HCl→H++Cl-
しかし実際はこのあとに水がH+を受け入れる反応が起きて電離が完了します。つまりこの塩酸が水に溶ける一連の反応は次のように表されます。HCl+H2O→H3O++Cl-
この場合には塩酸HClが水素イオンを出しているので酸、水は受け取っているので塩基として働いています。またアンモニアが電離する場合は次のように表されます。
NH3+H2O→NH4++OH-
これで3.の問題も解決されますね。この場合には、水が水素イオンを出してるので酸、アンモニアNH3がそれを受け取っているので塩基です。
アレニウスの定義とブレンステッド・ローリーの定義の比較
水は相手によって役割が違っていますね。ここがアレニウスの定義との大きな違いのひとつになってきます。
注意してほしいのは、ブレンステッド・ローリーの定義のほうが適用範囲が広くなっただけでアレニウスの定義を使わないわけじゃないということです。
後に出てくる中和反応などでは、無意識にどっちも使っています。
注意:水中において、水素イオンは上記のようにオキソニウムイオンのかたちで存在しますが、反応式が煩雑になるため、水素イオンH+と書いて、オキソニウムイオンH3O+を表すというルールになっています。
オキソニウムイオンでなく本当のH+(つまり陽子ですね)はprotonの頭文字pで表し、電離して生じたオキソニウムイオンとは区別します。
