すべての始まりは電池でした。
1800年、ボルタは電池を発明し、その後ダニエルによって改良されます。
実験に必要な電力を、当時としては十分に安定的に得られるようになり、電気化学の基礎が始まりました。電気分解の実験も盛んに行われ、1833年にはファラデーの法則が発見されます。
このように革命的な電池の発明によって、電気化学という化学の一分野が確立され、発展していきました。
しかし意外なことに「イオン」そのものに対する理解はまだ浅いままでした。例えば、
- 電子は当時まだ発見されていなかった()
- NaClなどイオン性物質を水に溶かした時に、いつイオンになるのか分かっていなかった
- 酸性・塩基性の性質は知られていたが「酸とは何か」「塩基とは何か」を知らなかった
でもとりあえずなんか流れてるぞって事は分かったので、当時の科学者は感覚的に「電流はプラスからマイナスに流れる」と定めました。
ちなみに電子は1897年にトムソンが発見しました。
さまざまな意見があったようですが、「水に入れた時はまだNaClの形、電圧をかけて電気の力を与えるとイオン化する」という説が主流だったようです。NaとClはプラスとマイナスで引き合っているのに、勝手に離れたりはしないだろうと思っていたのでしょう。
つまり「酸性の性質を示す原因」についての議論は混乱状態にあったといえます。
1887年、スウェーデンのアレニウスは次のような電離説を提唱し、当時の常識を覆しました。
アレニウスの電離説
「電解質は、水溶液中において、電場の有無にかかわらずイオンの状態で存在している」
「電解質は、水溶液中において、電場の有無にかかわらずイオンの状態で存在している」
アレニウスは、水に溶かしてイオンになることを電離と呼び、水に溶かすとイオンになる物質を電解質、そうでないものを非電解質と名づけました。
さらに電解質を、よく電離する強電解質と、あまり電離しない弱電解質に大別しました。
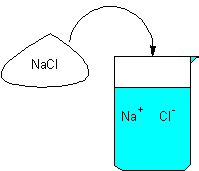
例えばNaClは、水溶液中で次のように電離しているとしました。
NaCl→Na++Cl-
さらに彼は電離説と同時に、当時混乱していた酸塩基に関する定義も定めました。
強酸として有名な塩酸HCl、硝酸HNO3は、水溶液中で次のように電離します。
HCl→H++Cl-
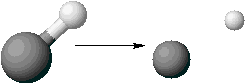
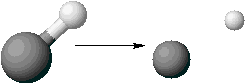
HNO3→H++NO3-
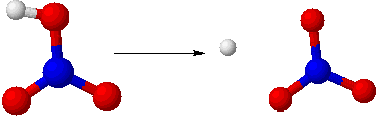
また硫酸は次のように2段階で電離します。

H2SO4→H++HSO4-
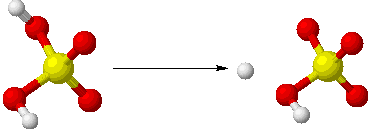
HSO4-→H++SO42−
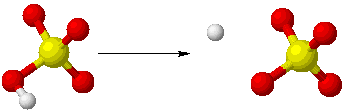
そして酸性を示す原因となる物質は水素イオンH+としました。
HSO4-→H++SO42−
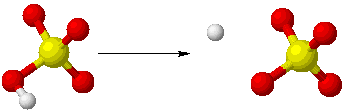
また強塩基の代表である水酸化ナトリウムNaOH、水酸化カルシウムCa(OH)2は、水溶液中で次のように電離します。
NaOH→Na++OH-
Ca(OH)2→Ca2++2OH-
そして塩基性を示す原因となる物質は水酸化物イオンOH-としました。このようにアレニウスは、酸性・塩基性の原因物質を明確化し、酸と塩基の定義を提唱しました。
これがアレニウスの定義です。
アレニウスの定義
酸(acid):水に溶けて電解し水素イオンH+を出すもの。
塩基(base):水に溶けて電解し水酸化物イオンOH-を出すもの。
また、強電解質や弱電解質と同様にして、よく電離してH+やOH-をたくさん出すものを強酸・強塩基とし、あまり電離せず少ししかH+やOH-を出さないものを弱酸・弱塩基としました。酸(acid):水に溶けて電解し水素イオンH+を出すもの。
塩基(base):水に溶けて電解し水酸化物イオンOH-を出すもの。
中和反応についても明確な定義を定めました。
中和反応:酸と塩基が反応して水と塩が生成する反応
中和反応の本質は水素イオンH+と水酸化物イオンOH-が次のように反応して水H2Oが生成することとしたのです。
H++OH-→H2O
そしてその時の副産物が「塩」であると定めました。このような、水素イオンH+と水酸化物イオンOH-による定義は有効かつ画期的であったため、広く認められました。
注意!!
「強い」「弱い」って漢字が似ていて分かりにくいことがあるので、このサイトでは次のように表記することがあります。
強酸→strong acid→sA
強塩基→strong base→sB
弱酸→weak acid→wA
弱塩基→weak base→wB
(正式な表記ではないので、学校や試験では使わない方がいいです。)
酸性や塩基性の本質は水素イオンH+と水酸化物イオンOH-だということが分かったので、酸や塩基は、放出できるH+・OH-の数によって分類することが出来ます。
1価の酸:塩酸HCl、硝酸HNO3、酢酸CH3COOHなど
2価の酸:硫酸H2SO4、シュウ酸(COOH)2、硫化水素H2Sなど
3価の酸:リン酸H3PO4など
1価の塩基:水酸化ナトリウムNaOH、水酸化カリウムKOH、アンモニアNH3など
2価の塩基:水酸化カルシウムCa(OH)2、水酸化マグネシウムMg(OH)2など
3価の塩基:水酸化アルミニウムAl(OH)3など
酢酸はHを4つ持っていますが、放出できるのはCOOHの先についているHだけです。それ以外のHは水に溶かしても電離しないので、価数には数えません。
またアンモニアNH3もHを3つ持っていますが、実際には水溶液中で水と反応して水酸化物イオンOH-を1つ放出するので、1価の塩基の扱いになります。
NH3+H2O→OH-+NH4+
この2つ以外は、見た目で価数がわかります。2/10追加
二酸化炭素CO2も次のように水と反応して酸性を示します。
CO2+H2O→H2CO3
出来た物質は炭酸と呼ばれ、2価の弱酸です。これも覚えておきましょう。