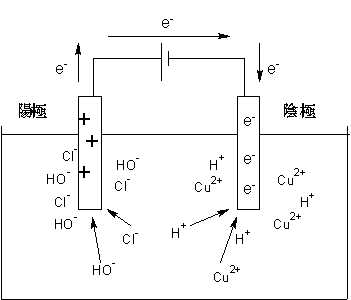
ここでは塩化銅水溶液の電気分解を例にして、電気分解の式を書く手順を紹介したいと思います。
1、イオン・極板確認
水溶液中のイオンをすべて書き出し、極板を確認します。
| 陽イオン: |
Cu2+ |
H+ |
| 陰イオン: |
Cl- |
OH- |
あまり意識する必要は無いのですが、H
+とOH
-を忘れないようにしましょう。
また
並べる順番はイオン化傾向を意識して弱い順(強い順)に並べることをお勧めします。理由は章が進んでいくと分かると思います。
次に極板は
陽極板:白金、陰極板:白金
を用いることにします。(このほかに炭素棒を用いることもあります。)ここでは
極板に余計な反応をされたら困るので、イオン化しにくい金属を用います。
2、生成物確認
次に析出、発生する物質を考えます。
前の章でも書きましたが、水溶液に電圧をかけると、電極にイオンが集まってきますね。
もう一度書きます。
陽極はプラスに帯電しているから陰イオンが集まり、陰極はマイナスに帯電しているので陽イオンが集まります。
このことはとても重要です。
この集まったイオンと電極の間で、電子のやり取りが行われ、先ほど書いたように、イオン化傾向の小さい順に追い出されます。
水溶液での反応では、追い出されたイオンは単体になります。ですから、陰極では
Cu2+が反応してCuが析出し、陽極では
Cl-が反応してCl2が発生します。Cuが析出すると、白金板の表面は単体の銅に覆われてしまいます。このように
表面を金属で覆うことを
メッキといいます。
ます。
3、半反応式
そして各極板でのイオン反応式(半反応式)を書きましょう。
あとは出入りする電子の数を合わせるのですが、
陽極は電子を抜かれるので電子は右辺、陰極は電子をもらうので電子は左辺です。
これらを踏まえると
陽極:2Cl-→Cl2+2e-
陰極:Cu2++2e-→Cu
このような半反応式が書けます。
4、全体の反応式
それでは全体の反応式を書きあげましょう。
やり方は簡単で、半反応式から電子e
-が消えるように調整して足すだけです。この場合は
2Cl-+Cu2+―→Cl2+Cu
これで完了です。
2e-は消えてしまいましたが、これが電気分解の計算問題で重要な部分になってきます。必ずどこかにメモしておきましょう。