1859擭丄僼儔儞僗偺僾儔儞僥偑敪柧偟偨揹抮偱丄尰嵼偱傕幵偺僶僢僥儕乕傗旕忢梡揹尮側偳偵梡偄傜傟偰偄傑偡丅尰戙偱傕巊梡偵姮偊傞墧拁揹抮偺堦斣偺億僀儞僩偼丄廩揹壜擻偲偄偆偙偲偱偡丅
墧拁揹抮偼晧嬌偵墧(奃怓)丄惓嬌偵巁壔墧(嘩)(妼怓)丄揹夝塼偵栺俁侽亾婓棸巁(枾搙栺1.25g/cm3)傪巊偭偰偄偰丄峔惉偼師偺傛偆偵昞偝傟傑偡丅
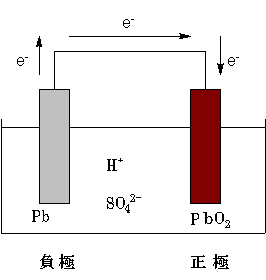
墧偲巁壔墧(嘩)偺偳偪傜偑晧嬌偱偳偪傜偑惓嬌偐丄崿棎偟傗偡偄偲偙傠偱偡丅僀僆儞壔孹岦偵傛傞敾抐偼擄偟偄偺偱丄巁壔娨尦斀墳偲偟偰偺尒曽偱峫偊偰偄偒傑偡丅偙偙偼侾復偵栠偭偰峫偊傑偟傚偆丅墧偺巁壔悢偼傕偪傠傫侽丄巁壔墧(嘩)偺拞偺墧偺巁壔悢偼亄嘩偱偡丅偲偄偆偙偲偼丄偙偺俀偮偺暔幙偺娫偱巁壔娨尦斀墳偑婲偒偨応崌丄偳偪傜偑巁壔嵻偱偳偪傜偑娨尦嵻偵側傞偱偟傚偆偐丠
壓恾偺娭學偼僉僢僠儕偲棟夝偟偰偔偩偝偄偹丅
巁壔墧(嘩)佁(帺暘偺巁壔悢崅仺掅丄憡庤偺巁壔悢掅仺崅)佁巁壔嵻丂佁揹巕栣偆佁丂惓嬌
偱偼弴偵斀墳傪尒偰偄偒傑偟傚偆丅
晧嬌偱偼丄忋偺昞偱尒偨偲偍傝丄巁壔偝傟偰俹倐2+偵側傝傑偡丅偟偐偟塼拞偺俽俷42-偲偡偖偵寢崌偟偰丄棸巁墧(嘦)俹倐俽俷4偲側偭偰嬌斅偵晅拝偟傑偡丅
偡傞偲惓嬌偱偼丄揹巕傪傕傜偭偰巁壔墧(嘩)偑娨尦偝傟傑偡丅偙偺偲偒丄晧嬌偲摨偠偔棸巁墧(嘦)俹倐俽俷4偲側偭偰嬌斅偵晅拝偟傑偡丅
墧拁揹抮慡懱偱偼丄偙偺傛偆側斀墳偑峴傢傟偰偄傑偡丅
丂丂丂惓嬌丂丗俹倐俷2亄係俫+亄俽俷42-亄俀倕亅丂仺丂俹倐俽俷4亄俀俫2俷
丂慡懱丂丗俹倐亄俹倐俷2亄俀俫2俽俷4丂佁丂俀俹倐俽俷4亄俀俫2俷
