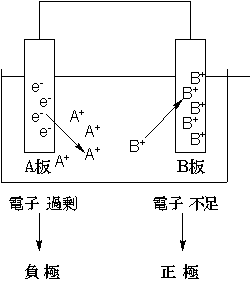
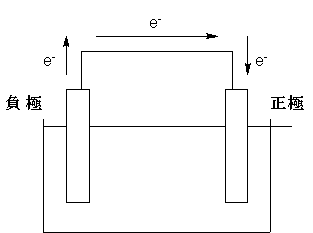
電池とは 化学エネルギーを電気エネルギーに変換する装置である、ということが出来ます。普通は2つの物質におけるイオン化エネルギーの差を利用します。
酸性水溶液にH2よりイオン化傾向の高い金属をいれると、その金属は溶けて水素が発生します。
たとえば亜鉛Znを希硫酸に入れると、亜鉛は溶けて水素が発生します。
Zn+H2SO4→ZnSO4+H2
でももっと細かく見てみると、実はこの反応の本質は次のイオン反応式Zn→Zn2++2e-(亜鉛が酸化されている)
2H++2e-→H2(水素イオンが還元されている)
で表すことができる酸化還元反応です。2H++2e-→H2(水素イオンが還元されている)
このとき、ここでは亜鉛と水素イオンの間で電子e-のやり取りがあります。もし何もしなければ、このやり取りに伴って余分なエネルギーが熱として放出されますが、熱エネルギーは回収しにくいし仕事をさせるのも難しいんです。
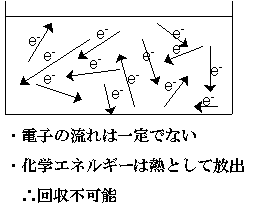
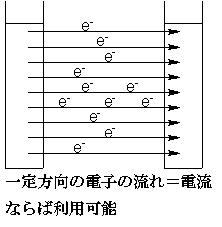
これが電池の基本原理です。