水素や天然ガスなどの燃料から、その燃焼による熱エネルギーの代わりに電気エネルギーを得る電池を燃料電池といいます。、中でも水素−酸素燃料電池はよく話題にされる代表的な燃料電池です。
この燃料電池は、有人宇宙船の電源になったということで有名ですし、最近では燃料電池自動車なども開発・実用化が進められており、教科書にも取り上げられているんですが、実はおおまかにいって2種類あるんです。違いは電解液です。基本的な構造が少しだけ違うので、分けて書いてみます。
電池電解編5.燃料電池
水素の燃焼熱を電気エネルギーに変換する装置です。
燃料電池の特徴
アルカリ型(アポロ型)
電解液に30〜45%水酸化カリウム水溶液、電極には正負どちらにも白金触媒をつけた多孔質電極、負極板に水素・正極板に酸素を吹き付けて使う水素−酸素燃料電池です。構成は次のように表されます。
(−)Pt・H2|KOHaq|O2・Pt(+)
起電力は約1.2Vです。アルカリ型の別名「アポロ型」は、アメリカの有人宇宙船(ジェミニ、アポロ号)の電源として用いられ、生成した水が乗組員の飲料水に用いられたことから付けられました。
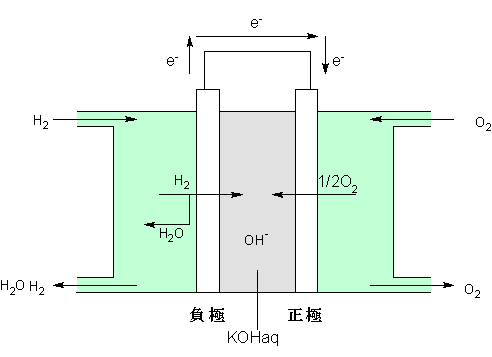
酸素は明らかに酸化剤だから正極、水素は還元剤だから負極です。
では順に反応を見ていきましょう。
負極にH2ガスを吹き付けると、一部はイオン化してH+となり、電解液に溶け込みます。このとき極板に電子を渡します。H+が電解液に溶け込むと即座にOH-と反応して中和し、水が生成します。
H2+2OH-→2H2O+2e−
正極板にはO2ガスが吹き付けられていて、一部は電極から電子を奪ってO2−となり、電解液に溶け込みます。すると即座にH2Oと反応して、電解液にOH−を供給します。O2+2H2O+4e−→4OH−
電池全体では、このような反応が行われています。
負極 :H2+2OH-→2H2O+2e−
正極 :O2+2H2O+4e−→4OH−
全体 :2H2+O2→2H2O
正極 :O2+2H2O+4e−→4OH−
全体 :2H2+O2→2H2O
リン酸型
こんどは電解液に95%濃リン酸水溶液を用いた電池です。構成は次のように表されます。
(−)Pt・H2|H3PO4aq|O2・Pt(+)
起電力もおなじ約1.2Vです。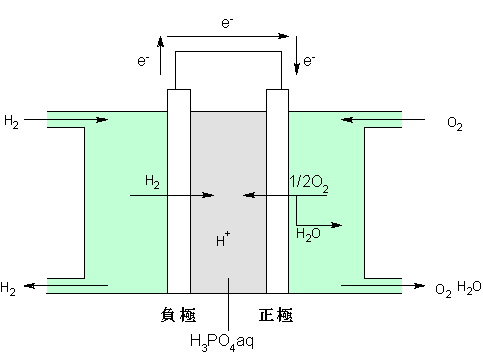
反応もほとんど同じですが、イオンが電解液に吸収されてからが少し違います。
負極に吹き付けられたH2は、イオン化してH+となり、電解液に溶け込みます。しかし特に反応はしません。ですから、反応は次のようになります。
H2→2H++2e−
正極では、電極から電子を奪ってO2−となり、電解液に溶け込みます。すると即座にH+と反応して、H2Oが生成します。O2+4H++4e−→2H2O
電池全体では、このような反応が行われています。
負極 :H2→2H++2e−
正極 :O2+4H++4e−→2H2O
全体 :2H2+O2→2H2O
正極 :O2+4H++4e−→2H2O
全体 :2H2+O2→2H2O
アルカリ型とリン酸型の違いは?
小さな違いも含めると3つあります。
1.水の出る場所が違う
アルカリ型は負極、リン酸型は正極から出ます。
水の出る場所の違いは、電解液のイオンによります。アルカリ型はOH-があるからH+と反応して水が生成し、リン酸型はH+があるからO2-と反応して水が生成します。
しかし、これは試験に出されることはあまりありませんね。反応の違いを覚える際のヒントにしてください。
2.イオンの動きが違う
鉛蓄電池のところに記述したように、電解液の中でも電荷を移動させないといけません。この際に、電解液の液性によってイオンの流れる方向が違ってきます。
アルカリ型はOH-が正極から出る
リン酸型はH+が負極から出る
という違いを確認してください。ここは試験で狙われたことがあります。リン酸型はH+が負極から出る
3.アルカリ型は電解液が汚染される可能性がある
アルカリ型では、空気中の二酸化炭素によって次の反応が起きる可能性があります。
2KOH+CO2→K2CO3+H2O
つまり、空気中の二酸化炭素によって電解液が汚染される恐れがあります。
対してリン酸型では、液性が酸性のために二酸化炭素が溶け込むことはありません。この差も訊かれることがあります。
後で出てきますが、水酸化カリウムやリン酸の電気分解とは逆の反応となります。このことも参考にして覚えていってください。
