1836年、イギリスのダニエルが考案した電池です。
ボルタ電池は、前回も指摘したとおり問題が山積みで、とても実用に堪えうるものではありませんでしたが、「イオン化傾向の差を電気エネルギーとして取り出す」という基本方針だけは引き継いで改良されました。
ダニエル電池も、極板に亜鉛と銅板を使うのは引継ぎました。電解液には、陽イオンに水素イオンH+を使うと水素が発生するので、硫酸銅水溶液と硫酸亜鉛水溶液を用います。
ダニエル電池の構成は次のように表されます。
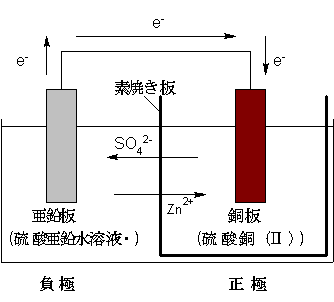
亜鉛板は自由にイオン化します。
銅板は相対的に電位が高くなるので、銅板は正極になります。
負極から送られた電子は、正極の銅板までやってきます。この電子は消費されなければならないのですが、銅は金属ですから、単体の銅が電子をもらって陰イオンになることは決してありません。 すると銅板自身が電子を使わないので、銅板がマイナスに帯電します。すると溶液中の陽イオンが引き寄せられてきます。
と、ここまではボルタ電池と同じなのですが、ここで引き寄せられる陽イオンが水素イオンではなく銅イオンなので銅板に銅の単体が析出します。
結果的に、ダニエル電池ではこのような電子の移動が行われています。
正極 : Cu2++2e−→Cu
全体 : Zn+Cu2+→Zn2++Cu
溶液の濃度をわずかに変えるだけで、ダニエル電池を少しだけ長持ちさせ、起電力を少しだけ上げることが出来ます。
負極では、亜鉛の単体がイオン化する反応が起きているので、負極の電解液の濃度は薄いほうがイオン化しやすいですね。
反対に正極では、電解液のCu2+イオンが単体になって析出していく反応が起きているので、もし電解液の中からCu2+イオンがなくなれば反応は終わりです。なので、正極の電解液の濃度は濃いほうが長持ちで反応が進みやすいですね。