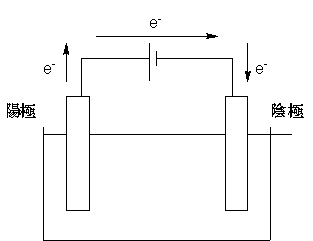
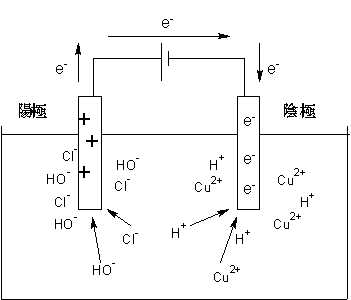
電池電解編の最初で「電池とは化学エネルギーを電気エネルギーに変換する装置」と書きましたが、電気分解はその反対の操作になります。一般に電池の放電と電気分解とは逆反応の関係にあります。
つまり、電気分解とは電気エネルギーを用いて化学反応を強制的に起こすという操作です。ですから自然には決して起こりえない反応も人工的に起こすことが出来ます。
例えば、硝酸銀AgNO3と塩酸HClを混合すると、塩化銀AgClの白色沈殿が生じます。
Ag++Cl-→AgCl↓ ・・・A
しかし、塩化銀を放置してAgとCl2に分解するということはありえませんね。不自然な反応ということです。
2AgCl→2Ag↓+Cl2↑??? ・・・B
Bの反応は、川の水が下流から上流へ逆流していくようなものですね。エネルギーの流れがおかしいんです。
Aの反応が起こるということは、Ag+とCl-は化学反応を起こす能力を持っているということです。(この能力を化学エネルギーといいます)
反応時に化学エネルギーは失ってしまいます。
川の水に喩えれば、高いところにある水が低いところに落ちるのは当然のことです。下に落ちてしまった水は、それ以上落ちることはありません。(つまり位置エネルギーを失っています。)
Bの反応はその逆です。何もしないのに化学エネルギーを得ているのはおかしいですね。
川の水に喩えれば、低いところにある水がいきなり高い場所に移るという現象です。おかしいですね。
しかし、水が低いところから高いところへ動くのは不可能なことなのかというと、そうではないですね。コップか何かに水を入れて、手で持って高く上げればいいのです。
同じように、塩化銀にエネルギーを与えてやれば、元の塩素と銀に戻ります。
このようにして「電気エネルギーを用いて化学反応を強制的に起こす」という操作を行うのが電気分解です。
電気分解の発明によって、水から水素を得る、金属酸化物から金属の単体を得るなど、それまでは困難・もしくは不可能であった反応ができるようになりました。