アルコールの反応性は第一級・第二級・第三級で異なりますが、そのどれにも共通する反応を書いていきます。
1.アルカリ金属との反応
2.ハロゲン化水素との反応
3.脱水反応
反応は共通して起きますが、反応のしやすさは変わってきます。
1.アルカリ金属との反応
アルコールにナトリウムなどの陽性の強い金属を加えると、ヒドロキシル基OHのHがNaに置換され、H2が発生してナトリウムアルコキシドが生成されます。
2C2H5OH+2Na→ 2C2H5ONa +H2↑
ナトリウムアルコキシド
<ナトリウムアルコキシド>一般式R-ONa
アルコールのヒドロキシル基のHが、Naになった化合物を指します。
命名法は、アルキル基Rの語尾「ィル」を「ォキシド」に換えて、その前にナトリウムをつけます。
英語表記だと「yl」を「oxid」に換えていることになります。
例.
エタノール⇒ナトリウムエトキシド プロパノール⇒ナトリウムプロポキシド
ethanol⇒sodiumethoxid propanol⇒sodiumpropoxid
C2H5OH⇒CH3CH2ONa C3H7OH⇒C3H7ONa
ナトリウムアルコキシドは、水に溶けると加水分解して強塩基性を示します。
C2H5ONa+H2O→C2H5OH+NaOH
またナトリウムの代わりにカリウムを用いても同様に反応し、カリウムアルコキシドが生成されます。2.ハロゲン化水素との反応
アルコールに濃塩酸などの濃ハロゲン化水素酸を加えると、ヒドロキシル基がハロゲンで置換されます。
C2H5OH+HCl→ C2H5Cl +H2O
1−クロロエタン
例に挙げた反応は(筆者はまだ試していないので保証は出来ませんが)たぶん、かなり起こりにくいと思われます(笑)単に書きやすくて教えやすいから教科書に載ってるんでしょうね。
この反応性の差を用いて、アルコールが第何級なのかを調べることが出来ます。
濃硫酸に触媒としてZnCl2を溶かした試薬をルーカス試薬といいます。アルコールにルーカス試薬を加えると、
第一級アルコール:常温では反応せず加熱が必要なため、反応しない。
第二級アルコール:反応開始までに数分ほどの時間を要する。
第三級アルコール:数秒で白色沈殿を生じる。
という違いが生じます。この反応の様子からアルコールの識別が可能です。
これをルーカス試験といいます。
3.脱水反応
アルコールの脱水反応は、分子内脱水と分子間脱水の2種類が起こります。
分子内脱水:1分子内で水1分子が奪われる反応
分子間脱水:2分子間で水1分子が奪われる反応
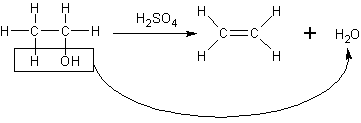
エタノールに濃硫酸を加え、160〜170℃に加熱すると、エチレンが生成します。
C2H5OH→CH2=CH2+H2O (触媒:H2SO4)
これは、エチレンの実験室的製法のところで一度見ましたね。この反応を詳しく見てみると、次のようにヒドロキシル基と隣のHが奪われているのが分かります。
B.分子間脱水
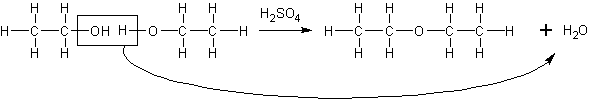
エタノールに濃硫酸を加え、130〜140℃に加熱すると、ジエチルエーテル(後述)が生成します。
2C2H5OH→C2H5-O-C2H5+H2O (触媒:H2SO4)
この反応のように、2つの分子から簡単な分子が奪われて2分子が結合する反応を縮合といいます。今度は、片方のエタノールの持つヒドロキシル基ともう片方の持つHが奪われていることが分かります。
アルコールの脱水反応では、第三級アルコールが一番脱水されやすく、第二級、第一級の順に脱水されにくくなります。
また、分子内脱水してアルキンが発生するか、分子間脱水してエーテルが生成するかは、反応温度によって決まります。ここでの反応のように、比較的高温度だとアルキン、比較的低温度だとエーテルが生成します。
