半反応式がややこしい理由
酸化還元反応も、酸塩基反応と同じで「授受」が大切なんだという話をしました。そうなると、出す側と受け取る側が存在するわけです。誰がどのように電子を放出し、どのように電子を受け取るか、というのは決まっているので「出し方」「受け取り方」を覚えておくだけで、無数にある化学反応式を丸暗記することなく導出することができます。
酸塩基反応の場合は「電離の式」がそれに相当するのですが、酸化還元反応の場合は「半反応式」がそれに当たります。
では何がややこしいかを考えてみましょう。
電離の式の場合、酸は勝手にH+が取れるだけで、塩基はOH-が取れるかH+を受け取るかすれば済みました。ですが酸化還元反応では、単に電子をもらったりあげたりしてイオン化とはいかないのです。というのも、酸化数が変わるということは、化合物自体ががらりと変化するということだからです。
そんなややこしいものを単に丸暗記というのは、あまり納得がいかないでしょう。中には「物質がどのように変化するかだけを覚えれば導出できる」という先生もいらっしゃいますが、テクニック化しすぎていて「操作の意味」はなかなか見えてきません。これだと、酸化還元反応の具体的なイメージは持ちづらいかもしれません。
酸化剤の反応機構
実際に、酸化剤がどのように反応して(つまり電子をもらって還元されて)いるかを考えてみると、反応の意味がわかるのではないか、と私は考えています。
ここでは有名な酸化剤である過マンガン酸カリウムKMnO4を例にとって考えてみます。
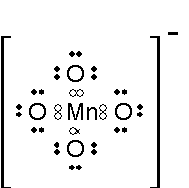
過マンガン酸イオン MnO4-
注※白球はMnの電子 ×印はKの持っていた電子 K+は省略
マンガンの酸化数を計算すると
(-2)×4+x=-1 ∴x=+7
となって酸化数は+Ⅶです。ルイス構造式を見ると、周りにある酸素はすべて酸化物イオンなので、マンガンは8個の電子がとられているように見えます。ですが、ひとつはKが差し出した電子なので、これを差し引いて7個の電子がとられていることになります。注意すべきは、マンガンと酸化物イオンはイオン結合で結ばれているということです。つまり、マンガンの周りにある8つの電子はすべて完全に酸化物イオンのものであって、マンガンは電子を1つも共有していません。なのでここでは、周りの8つの電子は誰のものでもよくて、マンガンが7つの電子を酸素にとられたということだけが重要です。
この状態というのは、マンガンの最外殻の4s軌道とそのもうひとつ下の3d軌道が丸裸になっていて、最も酸化されている状態です。ここでもし周りの酸素原子がなくなってくれれば、もっと酸化数の小さな安定した状態になれます。これがキーポイントです。
酸素を取り除くには、水になってもらうのが一番です。なので、水素イオンH+があって、酸化物イオンが水素イオン2つとぶつかってくれれば、水になって離れてくれます。
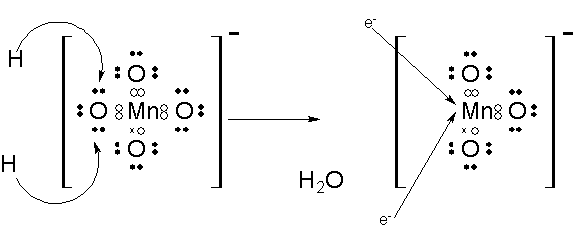
このときに2つの電子が不足しますが、還元剤があれば周りの酸素が勝手に取ってきます。もし還元剤がなく電子の補填ができないなら、マンガンが周りの水を引きつけて元に戻ります。なので還元剤は必須です。
酸素原子がどれくらい離れてくれるかは、水素イオンの濃度がどのくらいかによります。もし酸性なら、酸素原子に水素イオンがたくさんぶつかって、最終的に全部とれます。ですが過マンガン酸カリウムは酸性物質ではないので、酸を加えてやらなければならないのです。そこで、酸化作用を持たない硫酸を適量加えてやります。これが硫酸酸性の意味と理由です。
今までの動きをおさらいしましょう。すべて反応が終わってMn2+ イオンになったとき、合計8つの水素イオンがぶつかって酸素原子を運んで行き、酸素は5つの電子をマンガンに供給したことになります。
なんで5個なのでしょう。まず、最後の酸素が行ってしまうとだれも電子を補給してくれる人がいなくなってしまうの、で最大でも6個しか補給されませんね。また、補給が必要なのは「もともとマンガンが出していた電子」だけで十分です。1つはKがくれた電子なので、結局5つだけで十分ということになります。マンガンは遷移元素なので、ルイス構造式の上では奇妙なことが起きていますが、これで十分です。
また、このときのマンガンの酸化数は+Ⅱ(Mn2+)で、ちょうどM殻が埋まって安定です。それ以上もらっても仕方ないんですね。
これをイオン反応式にしてみましょう。次のようになります。
MnO4-+5e-+8H+ → Mn2++4H2O
もし硫酸を加えず十分な水素イオンがない場合は、まわりにある水がぶつかってきて酸素を奪っていきます。
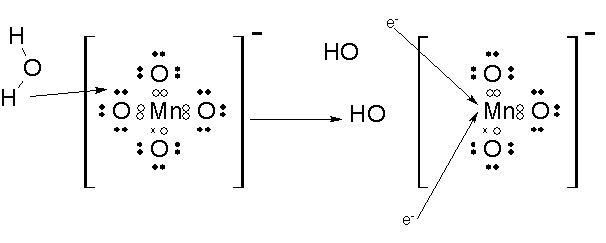
ですが、水素イオン+に帯電しているのに対して水は中性物質なので、マンガンと強く引き合っている酸化物イオンはそう簡単には離れてくれません。結局、半分だけ取れたところでMnO2となって安定します。
これもイオン反応式にしてみましょう。酸化物イオンを1つ取り除くのに1つの水が必要で、水酸化物イオンが2つできます。ですから、合計2つの水がぶつかってきて水酸化物イオンが4つできました。肝心の電子ですが、これは3つだけで十分です。
MnO4-+3e-+2H2O → MnO2+4OH-
教科書の半反応式と見比べてみてください。結果が一致しているでしょう。これが半反応式の意味です。他の酸化剤についてもぜひ考えてみてください。
酸化数との関係
前回説明した酸化数と、今回の半反応式とは密接な関係があります。
マンガンは、酸素が抜けるときに電子を補給してもらいましたが、この補給された電子というのはもちろんマンガン自身のものになります。なので、マンガンの酸化数の変化は、補給された電子の数と必ず一致します。これは実際に確かめてください。
この関係は、どんな酸化剤も還元剤もみんな成立します。センターなどで「酸化数が一番大きく変化したのはどれか」という問題がよく出題されますが、これは半反応式を覚えておくだけで十分に対応できます。
