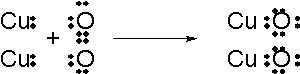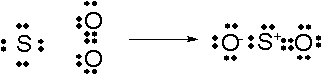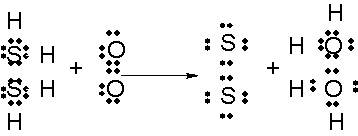これまで酸素と水素による定義をしてきましたが、まだまだこれだけでは狭いですね。酸素や水素の絡まない反応にはまだ対応できません。そこで酸素や水素の出入りの時に何が起きているのかということを突き詰めて考えていく必要があります。
ここは答えを先にバラしてしまいましょう。実は酸素は電子を奪い取り、水素は電子を与えるはたらきをしているのです。
ヒントは電気陰性度です。これは電子を引き付ける強さの度合いでしたね。周期表で右ほど強く、左ほど小さいのでした。
電気陰性度について復習しましょう。非金属元素と非金属元素は、不対電子を出し合って共有結合をするのでした。原子核は当然プラスに帯電しているので、電子を引き付ける力を持っているのですが、しかし共有といっても元素間に力関係があるので共有電子対は対等に引き合っているわけではないのです。その力関係の尺度が電気陰性度です。
また水素は非金属の中で一番電気陰性度が小さく、酸素は非金属の中で二番目に大きい元素です。これを踏まえると、
酸素をもらう:強い酸素に自分が出した分の電子を取られる
酸素をわたす:強い酸素に取られていた電子が返ってくる
水素をもらう:弱い水素の持っている電子がもらえる
水素をわたす:弱い水素から奪っていた電子を返さなければならない
という現象が起きます。
ここでは共有結合について考察しましたが、イオン結合の場合は考えるまでもないですね。これは金属が電子を放出し、非金属が電子を奪っている関係なのですから。
以上を踏まえると、酸化還元反応の本質は電子のやり取りにあったということです。そこで、酸化還元の定義を次のように書くことができます。
- 酸化
- 物質が酸化されるとは、その物質が電子を奪われること。
- 還元
- 物質が還元されるとは、その物質が電子を受け取ること。
この定義が高校化学での一般的な定義になります。定義なので、これは受け入れるしかありません。先人が試行錯誤した末に、一番便利だと認められたものがこれです。今は先人の苦労をもう一度味わう必要はありません。もちろん、化学が好きな人はもっと深い考察をしてみたらいいと思います。
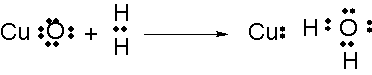
さて、この観点からもう一度反応を見直してみましょう。まずは銅が酸素と化合する反応です。
2Cu+O2→2CuO
銅と酸素の両方の立場に立って考えてみましょう。
金属は原子がたくさん集まって電子を全体で共有する金属結合
金属単体は一般に電気陰性度が低い
CuO+H
2→Cu+H
2O