3.エネルギー準位図の利用
実は、図を描くだけで解ける方法もあります。矢印の向きや、横棒の位置、あとは少々のテクニックを掴めば、最も視覚的に理解しやすい方法ではあります。また、後述する「結合エネルギー」の節において、エネルギー準位図の理解は必須です。
① B、C、Dの中で最も複雑な式を選び、図示する
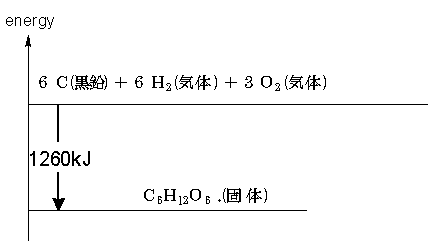
② 残りの反応を順番に書き加える。この時、反応熱は係数に十分注意し、足りない物 資があってもマイナスの物質を作ってごまかす
まずBを反応させてみます。

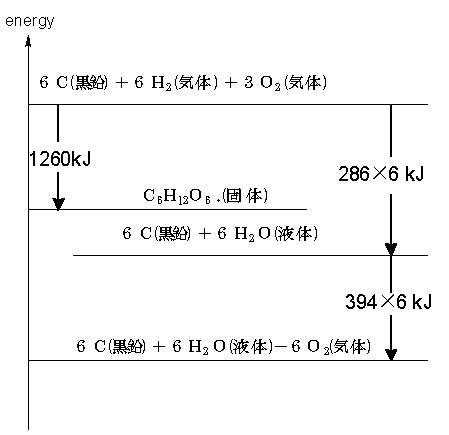
③ マイナスの物質を消去する
図上全てのマイナス物質を消去します。ここでは、6O2(気)を加えます。この時、反応熱に変化はありません。
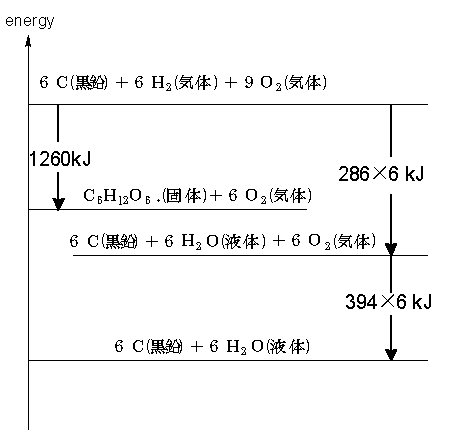
④ 求める反応熱QkJを書き加え、へスの法則を適用する
発熱・吸熱に注意して矢印を加えます。これを書き込めば、求める反応式が自ずとあらわれます。
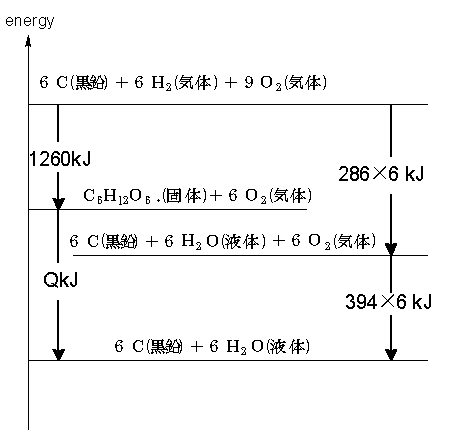
1260+Q=(286×6)+(394×6) ∴Q=2820kJ
よってグルコースの燃焼熱は、2820kJ/mol
4.公式利用
そして公式に代入するだけの方法もあります。反応熱の公式 反応熱=(生成物(右辺)の生成熱の和)-(反応物(左辺)の生成熱の和)
この公式の解説に入る前に、式B、Cに注目してください。式Bについて、これは、水素の燃焼熱を表していますが、同時に水の生成熱も表していますね。右辺では、水1molだけができていますから、これに着目して解釈したらそうなります。
同様に、式Cも二酸化炭素の生成熱であると読みかえることができます。
このように、熱化学方程式が多くの意味を持つことは、少なくありません。
さて、この公式もへスの法則に基づくものです。
エネルギー準位図を見てみましょう。
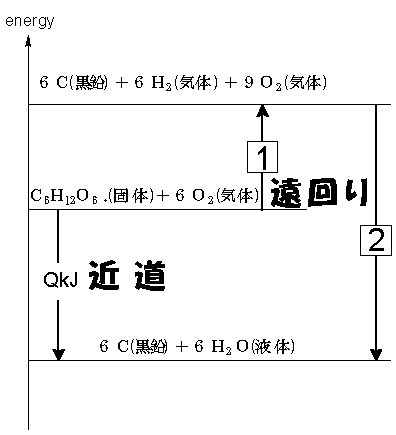
すると、遠回りしてるほうの道は、何をしているかというと、
① 反応物をいったん全て単体に戻す。
② 戻した単体から別の物質に作りかえる。
レゴブロックとか、ダイヤブロックとかありますよね。レゴで作った城とかがあって、これを全く別の、例えば軍艦などに作り変えたいわけです。
この時、城から直接軍艦にするのは無茶だから、いったんパーツを全部バラバラにしてから作りかえる方法が普通ですよね。そんな感じです。
この時、①というのは、グルコースの生成熱
6C(黒鉛)+6H2(気)+302(気)=C6H1206(固)+1260kJ・・・D
の逆反応になっていて、 ②というのは、水と二酸化炭素の生成熱H2(気)+1/2O2(気)=H2O(液)+286kJ・・・B
C(黒鉛)+O2(気)=CO2(気)+394kJ・・・C
ここから、逆反応は矢印の向きがかわるので、
反応熱=(生成物(右辺〉の生成熱の和)-(反応物〈左辺)の生成熱の和)
という公式が成立します。これを、式Aに適用しますと、単体の生成熱は、0ですからQ=(286×6+394×6)-(1260-0)=2820kJ よって、グルコースの燃焼熱は、2820kJ/molである。
この方法には少し注意が必要です。 例えば、「グルコースの生成熱を求めよ」という問題が出たとき、生成熱の式そのものに対して公式は無力です。生成熱の式の左辺は、全部単体のはずですからね。そんな時は、グルコースを含む別の式(例えば燃焼熱など)に公式を適用して下さい。
以上 4つの解法を紹介しましたが、全てにメリットとデメリットの両面がありますので、できるだけ4解法どれも使えるようにしておくのがよいでしょう。
