物質が化学反応をするときには、必ず熱の出入りを伴います。
たとえば携帯用カイロの中には鉄粉が入っていて、これが酸化するときに発する熱を利用して温まっているわけですね。逆に、冷却パックなるものもありまして、これは硝酸アンモニウムが水に溶けるときに、周りから熱を奪うということを利用しています。
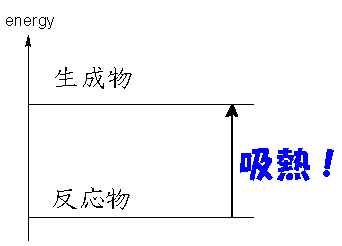
このように熱を発生しながら進む反応を発熱反応、熱を吸収しながら進む反応を吸熱反応といいます。
では、なぜ必ず熱の出入りがあるのでしょうか。
物質はそれぞれ固有のエネルギーを持っています。これを化学エネルギーといいます。化学反応が起こると、反応前の物質と反応後の物質とで保有するエネルギーに差が出ます。
つまり反応熱とは"反応物のエネルギーと生成物のエネルギーとの差が熱の形で現れたもの"ということができます。
これを視覚的に見やすくしたのが「エネルギー準位図」です。
カイロの例を見てみましょう。
物質が持つ化学エネルギーの絶対値は残念ながら求めることができないのですが、他の
物質と比べた相対的なエネルギーの高低は分かります。
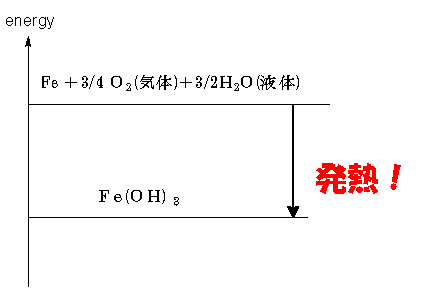
右図がエネルギー準位図です。鉄粉(Fe)が水酸化鉄(Ⅲ) Fe(OH)3になる反応、これがカイロで起きている化学反応です。
エネルギー準位図を見ると、生成物Fe(OH)3より反応物である鉄粉・酸素・水の混合物のほうが高いエネルギーを持っていることが分かります。(分数係数になっていたり(気体)や(液体)などの記号がついていたりしますが、後で説明します。)カイロの中で鉄粉が酸化される反応が始まると、この化学エネルギーの差だけ熱が放出されます。
逆に吸熱反応のとき、反応物より生成物のほうが高いエネルギーを持っています。この時周りから熱を奪って化学エネルギーに換えてるんですね。