塩酸と固体の水酸化ナトリウムとを反応させるとき、次の2つの反応経路を考えることができます。
(Ⅰ)1molの塩化水素が溶けている塩酸に,固体の水酸化ナトリウム1molを直接投与して反応させる。
(Ⅱ)まずは固体の水酸化ナトリウム1molを十分な水に溶かし,次に1molの塩化水素が溶けている塩酸を加える。
(Ⅰ)の反応を熱化学方程式で書くと、次のようになります。
HClaq+NaOH(固)=NaClaq+H2O+100.9kJ
(Ⅱ)の反応は,次の2段階の操作を行っています。
NaOH(固)+aq=NaOHaq+44.5kJ
HClaq+NaOHaq=NaClaq+H2O+56.4kJ
ここで、(Ⅱ)の経路を通して出た熱量を見てみると、 44.5+56.4=100.9 となっています。このように、反応を一気に進めても、多段階に分けて行っても、出入りした熱量の総和は一緒になることが分かります。HClaq+NaOHaq=NaClaq+H2O+56.4kJ
化学者ヘスは、この例のようにどんな反応経路をたどっても最終的に出入りする熱量は同じという関係を多くの反応について実証し、次の法則を導きました。
総熱量保存の法則 (ヘスの法則 )
化学反応の反応熱は、反応の最初と最後の状態が同じなら、どんな反応経路や方法をとっても、反応熱は同じになる。
この法則が何に役立つのかというと、実験しなくても計算によって反応熱が求められるということですね。
例えば一酸化炭素COの生成熱を測ってみようと思ったときに、実測するには黒鉛を不完全燃焼させればいいんです。しかし、どれだけ頑張っても一部はCO2になってしまって「CがすべてCOになった」という状態を作ることが困難なため、事実上、実測は不可能です。
しかしこれをヘスの法則によって解決することが出来ます。
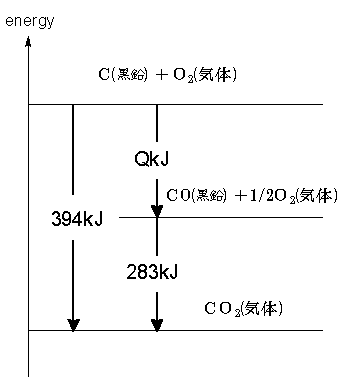
まず知りたいCOの生成熱をQkJとおいて、熱化学方程式を書いてみると、
C(黒鉛)+1/2O2(気)=CO(気)+QkJ・・・①
となります。さて、Cの燃焼熱とCOの燃焼熱は実測可能で、これはそれぞれ394kJ・288kJにな ることが知られています。
C(黒鉛)+O2(気)=CO2(気)+394kJ・・・②
CO(気)+1/2O2(気)=CO2(気)+283kJ・・・③
ここでエネルギー準位図を見てみましょう。CO(気)+1/2O2(気)=CO2(気)+283kJ・・・③
熱化学方程式の節で述べましたが、これらの熱化学方程式は数式のように計算してもOKということになっています。
エネルギー準位図を見ると、Cの燃焼熱394kJからCOの燃焼熱283kJを引くとQが出そうですよね。ですから、ここで式②-式③という演算をしてみます。
C(黒鉛)+O2(気)=CO2(気)+394kJ
-)CO(気)+1/2O2(気)=CO2(気)+283kJ
-------------------------------------------
C(黒鉛)-CO(気)+1/2O2(気)=111kJ
-)CO(気)+1/2O2(気)=CO2(気)+283kJ
-------------------------------------------
C(黒鉛)-CO(気)+1/2O2(気)=111kJ
CO(気)を移項して、
C(黒鉛)+1/2O2(気)=CO(気)+111kJ
よってCO(気)の生成熱は、111kJ/mol
このようにして反応熱を計算で求めることが可能になったんですね。
