2章「σ結合・π結合」で紹介したπ結合ですが、π結合に関与している電子をπ電子といいます。(同様にσ結合に関与している電子をσ電子といいます。)
π結合は、二重結合や三重結合などが持っているのですが、時に単結合をはさんでπ結合同士がつながることがあります。
次の物質は1.3-ブタジエンという名称です。(青番号は便宜上振り分けたものです)
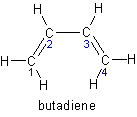
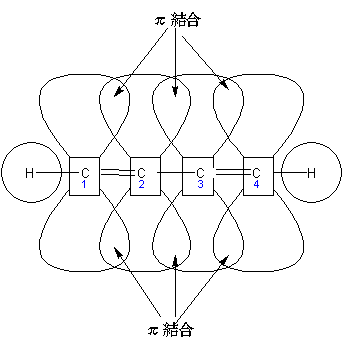
では実際に単結合と二重結合が交互になっているかというと、実は3つの結合はすべて同じ長さになっています。1.7重結合とでも言うのでしょうか。
-hexa-1,3,5-triene.gif)
そして、やはり1番炭素のπ電子は6番炭素のπ電子軌道までいくことが出来ます。
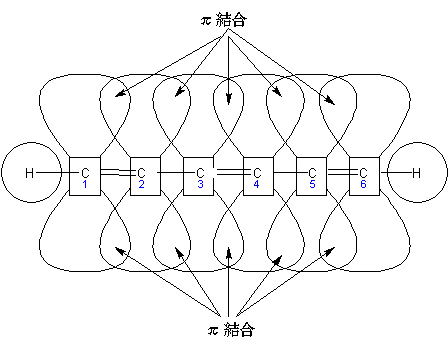
このように、π電子がある特定の場所に縛られている(局在化している)のではなく、多くの炭素原子の間に広がるように存在していることをπ電子の非局在化といい、
π電子軌道がつながることを共役といいます
※補足
π電子軌道が「共役」すると、π電子が「非局在化」します。
軌道のことを言っているのか、π電子のことを言っているのかが異なりますので、注意してください。
つまり「単結合と二重結合が交互になっている」ということがポイントだと分かりますね。このような二重結合を特に共役二重結合といいます。
このようにπ電子が非局在化すると、π電子は行動可能範囲が広がります。行動範囲が広がると分子全体のエネルギーが小さくなります。
これはハイゼンベルグの不確定性関係(もしくは不確定性原理)と呼ばれるのですが、本ページの範囲をあまりにも逸脱するので、解説は省略します。
