まずは復習から入りましょう。
電子式
有機物質のほとんどは、原子と原子が共有結合でつながっています。共有結合とは、お互いの電子を出し合って共有することで、手をつなぐように結ばれる結合です。
そのため、まずはどんな原子が何個の電子を持っているのかを知る必要があります。そのために、原子の周りにある電子の状態を表示したものを電子式といいます。
まずは見てみましょう。有機化学で最もよく出てくる原子は、炭素C・水素H・酸素Oの3つですので、これらの電子式を最初に見て見ましょう。
![]()
![]()
![]()
黒丸は、一箇所にかためて書いたりせず、なるべくばらけるようにします。
有機化学に登場する原子は、それに次いでハロゲンX(塩素Cl・臭素Br・ヨウ素Iなど)、窒素N、硫黄Sなどがあります。
![]()
![]()
![]()
電子対・不対電子
ここからが重要です。 原子中の価電子は2個で対になったときが安定で、1個だけだと不安定で対を成そうとして別の原子の電子をもらおうとします。このように2個の価電子が対になったものを電子対、対にならずに単独のまま存在する電子を不対電子といいます。不対電子は、電子対をつくるために、別の電子と電子を出し合ってお互いの電子を共有することで結合します。このような結合を共有結合といいます。
このとき、2つの原子に共有されている電子対を共有電子対といいます。
水とメタンの場合
・・ ・・
H・→ ・O・ ←・H ⇒⇒ H:O:H
・・ ・・
水
H
・
↓
H
・・ ・・
H・→ ・C・ ←・H ⇒⇒ H:C:H
・・ ・・
H
↑
・ メタン
H
共有結合がつくられると、OH間・CH間に新たな軌道ができて、電子はその中に収容されます。このように不対電子と不対電子を1個ずつ電子を出し合って出来る結合を単結合といいます。
では、2個ずつ・3個ずつ電子を出し合った場合はどうでしょうか?
酸素と窒素の場合
・・ ・・ ・・ ・・
:O・→ ←・O: ⇒⇒ :O::O:
・ ・ ・・ ・・
酸素
・ ・ ・・..・・
:N・→ ←・N: ⇒⇒ :N::N:
・ ・ ・・ ・・
窒素
上記のように、1個ずつ出し合っただけでは不対電子が余ってしまうとき、2個目・3個目の不対電子も共有して、共有結合を形成します。このような2個ずつ電子を出し合って出来る結合を二重結合・3個ずつ電子を出し合って出来る結合を三重結合といいます。
配位結合
ところで、不対電子でない、最初から対になって存在している電子対は、すでに安定しているので普通は共有結合に参加しません。このような電子対を、共有電子対に対して非共有電子対といいます。
非共有電子対は共有結合に参加したがる性質を持っています。そのため、電子対を一方的に空軌道に受け取らせて共有結合をつくることがあります。このような共有結合を特に配位結合といい、 非共有電子対を与えている原子をドナー原子、それを受け入れている原子をアクセプター原子といいます。
オキソニウムイオンとアンモニウムイオンの場合
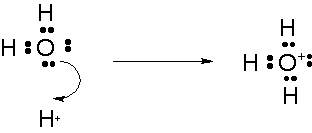
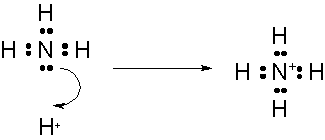
配位結合をしたのちに出来た共有結合は、不対電子を1個ずつ出し合った共有結合と全く変わらないものになります。ですから区別がつかないのですが、あえて配位結合を表す場合には、ドナー原子からアクセプター原子に向かって→の価標を使うこともあります。
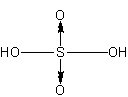
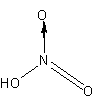
このほか、硫酸や硝酸なども配位結合で出来た物質です。
硫酸は、まずS原子が2つのOHと共有結合をしています。
.. ・・ .. ・・ ・・ ・・
H:O・→ ・S・ ←・O:H ⇒⇒ H:O:S:O:H
・・ ・・ ・・ ・・ ・・ ・・
またO原子は、次のように電子が移動して、空軌道が出来ます。
.. ・・
:O・ ⇒⇒ :O:
・
そして中心のS原子は、O原子の空軌道に配位結合し、硫酸分子ができます。
・・
:O:
・・
↑ :O:
・・ ・・ ・・ ・・ ・・ ・・
H:O:S:O:H ⇒⇒ H:O:S:O:H
・・ ・・ ・・ ・・ ・・ ・・
↓ :O:
・・
:O:
・・
この状態を、構造式では次のように書きます。