まずは復習から入りましょう。
共有結合が切断される時、2つの原子で共有していた電子は「1つずつに分かれる」か「片方が2つもつ」かのどちらかになります。
塩素分子のCl−Cl結合で見てみましょう。
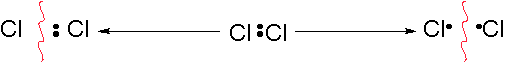
ヘテロリティックな開裂 ホモリティックな開裂
電子対が片方にかたよる 電子を1つずつ受け取る
このようにして出来る粒子は、3種類あることがわかります。
- Cl のように 電子を奪われた状態⇒⇒Cl+(塩素陽イオン)
- Cl:のように 電子を受け取った状態⇒⇒Cl-(塩素イオン)
- Cl・のように 不対電子を持った状態⇒⇒Cl・(塩素ラジカル)
求電子試薬
はじめて有機反応を見た人は、まずCl+という物質に対して???となってしまう人が多いのではないでしょうか。この状態はClが電子を無理矢理奪われた状態で、+1の電荷を持っています。ですからこのような物質は、電子を求めて反応を起こしますので求電子試薬(electrophilic reagent)といいます。
もしくは親電子試薬といったり、プラスに帯電しているので陽性試薬(cationoid reagent)と言ったりします。
求核試薬
逆にCl-は電子を受け取らされた状態で、−1の電荷を持っています。Cl-が安定的に存在できるのは、水溶液中のみです。ですから、水溶液中での反応が多い無機反応・酸塩基反応・酸化還元反応などでは安定したイオンとして扱われますが、有機化学では空気中の反応や有機溶媒中の反応が多いので、不安定な状態として扱われることが多いです。
このような物質は、+に帯電している原子核を求めて反応を起こしますので求核試薬(nucleophilic reagent)といいます。
もしくは親核試薬といったり、マイナスに帯電しているので陰性試薬(anionoid reagent)と言ったりします。
ラジカル
最後に、2つの電子が1個ずつ電子を受け取った状態がありますが、これは電気的には中性でも不対電子を持っているので非常に不安定です。このような物質は、誰彼構わず攻撃して結合しようとするのでラジカル(radical:過激な)といいます。
