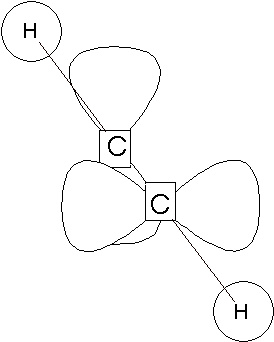
前回では「電子式」という表現方法で共有結合を見てきました。こんどは、どのように不対電子がやりとりされるのかを見ていきます。
電子は、原子核の周りにある電子殻に収められていますが、実際にはもっと細かい電子軌道があって、その軌道を回っています。1つの電子軌道には2つまで電子を入れることができ、また2つ入った状態が安定です。
不対電子を持った2つの電子軌道が近づくと、電子軌道が重なりをもって結合し、新しい電子軌道をつくりだします。2つの電子はその軌道に入り、安定した状態になります。
その際に2種類の結合ができます。
σ結合
- 単結合するときにできる
- π結合に比べると切断されにくい
- σ結合は回転に対してほぼ抵抗しない
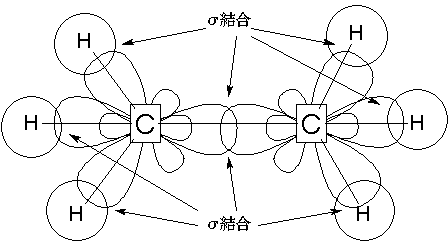
σ電子軌道は、立体的なエクスクラメーションマーク「!」のような形をしていて、C原子の中心から正四面体の頂点に向かうように出ています。
C−C結合を中心に回転しても、つながりが切れることはないため、回転に対してはほとんど抵抗しません。
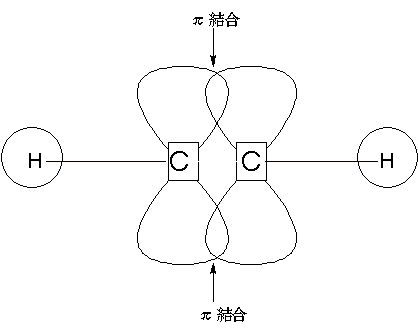
π結合
- 二重結合、三重結合、ベンゼン環などの不飽和結合が持っている
- σ結合に比べると切断されやすい
- π結合は回転できない
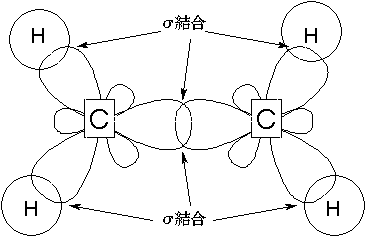
平面に対して真横から
平面に対して真上から
エチレンを例にとって見てみます。
π電子軌道は、気球を8の字にくっつけたような形をしています。
C−H結合・C−Cのσ結合は同一平面上にあるため、π結合はその平面とは垂直にのびて、側面で重なりをもちます。結合力はσ結合にくらべて小さく、70%くらいの強さです。
結合軸のまわりで回転すると、π結合の側面同士のつながりが切れてしまうため、回転に対しては強い抵抗を示します。
もし回転すると・・・