モルとは何かを考えるために、思考実験をしようと思います。
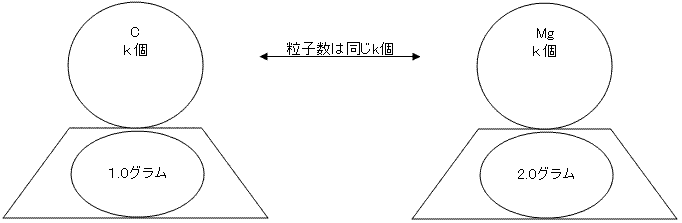
ここに、原子1個の重さを測ることのできる質量計があったとします。12C原子を質量計に乗せてみたところ、aグラムと出ました。次に24Mg=24の質量を測ってみようと思います。ですが、質量計に乗せるまでもなく結果は分かっています。2aグラムと出るはずですね。原子量が12C原子の倍なのですから。実際に質量計に乗せてみると、2aグラムと出ました。
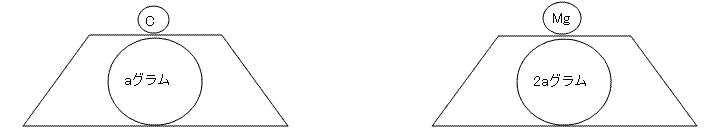
もう1個ずつ乗せてみます。12C原子2個の質量は2aグラム ,24Mg原子2個の質量は4aグラムです。

一気に飛んで、10000個ずつ乗せてみましょう。12C原子10000個の質量は10000aグラム ,24Mg10000個の質量は20000aグラムになります。
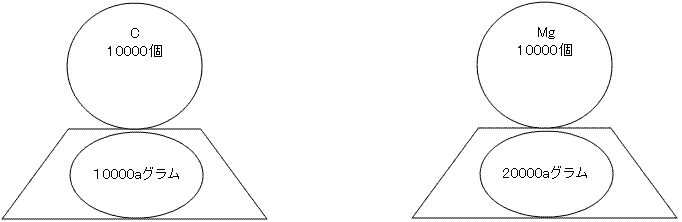
ここで注意したいのは、同じ個数を乗せている時には質量比が1:2で変わっていないということです。さらにこの比は原子量の比に等しい値になります。