分離とは
何種類かの物質が、単に混ざり合っただけのものを混合物といいます。
たとえば海水には、水H2Oに、食塩NaCl、塩化マグネシウムMgCl2などの物質が溶け込んでいますし、空気は窒素78%、酸素21%、アルゴン0.9%などの成分で出来ています。
混合物から純物質を取り出す操作を分離といい、さらに不純物をとりのぞいて純度を高める操作を精製といいます。いまから紹介する分離法は、ろ過・蒸留・分留・再結晶・蒸発乾固・抽出・昇華法の7種類です。
重要なのは、詳しい操作よりも、それぞれの分離法がどんな目的に適しているかを理解し、適切な分離法を選べるかどうかです。
1.ろ過(filtration)
目的:液体中に混ざった不溶性固体粒子を分離する。不溶性固体粒子とは、要は沈殿物であったり、砂などのもともと水に溶けない固体などを指します。主に沈殿物を取り除いたり、水溶液に混じった砂などを取り除くときに用いられる方法です。
用具:主に漏斗とろ紙を使います。
1.ろ紙を4つ折にして円錐状に開き、漏斗に当てながら蒸留水で軽く湿らせ、漏斗に密着させる。
コーヒーを入れるときのような操作ですね。これは漏斗とろ紙を密着させてろ過効率を上げるためのものです。
2.漏斗の足は斜めの切り口になっているが、先の長いほうをビーカーの内壁に付ける。
中学のときからよく問われる問題です。ポタッポタッと落ちるより、内壁を伝って連続的にろ液が流れ出るほうが効率がいいです。
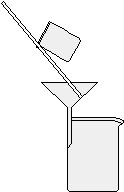
3.ろ過したい溶液は静置しておいて、固体が底のほうに沈んだままの状態にしておく。そうしてから、まずは上澄み液を漏斗の8分目まで入れる。
前半の操作の目的は分かりますか?これは目詰まり防止のための操作です。いきなり砂とかまで漏斗に入れてしまったら、なかなかろ過されません。ろ過する際はガラス棒を伝わせていれます。
4.ろ過が進んだら、少しずつ溶液を加える。
最初はスーッと水位が下がっていくのが分かるかも知れません。無くなってから一気に入れるんじゃなくて、すこしずつ溶液を足していきます。やはり目が詰まるとろ過速度が下がるので、上澄み液からろ過していきましょう。
2.蒸留(distillation)
目的:不揮発性物質が溶けている水溶液から、液体を分離する。不揮発性物質とは、主に常温で固体・液体の物質を指します。たとえば海水から蒸留水を作ったりするときなどに用いられます。
用具:主に枝付きフラスコやガスバーナーなどが用いられます。
例:塩化ナトリウム水溶液から蒸留水を作る。
1.例のような装置を組み立てる。
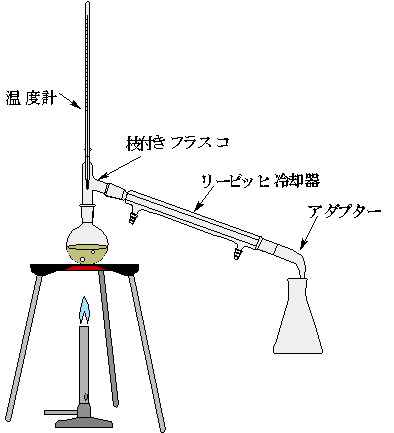
さて実験装置の注意点を挙げておきます。これは頻出です。
蒸留装置の組み立て注意点
- 温度計の液溜りが枝付きフラスコの枝の付け根になるようにする。
- フラスコの1/3まで液を入れるのが目安。決して半分以上入れない。
- フラスコには沸騰石を入れる。
- リービッヒ冷却器は下から上に向かって水を流し、水は使ったら捨てる。
- アダプターとビーカーの間は密栓しない。
